- 醇类简介
- 共8题
甲醇是一种基础的有机化工原料和优质燃料。利用合成气(主要成分为CO、CO2和H2)在催化剂作用下可以合成甲醇,主要反应如下:①CO(g)+2H2(g)


27.已知反应①中相关的化学键键能数据如下:
28.反应①、②、③对应的平衡常数K1、K2、K3之间的关系是____________;随着温度的升高,K1_________(填“减小”、“增大”或“不变”)。
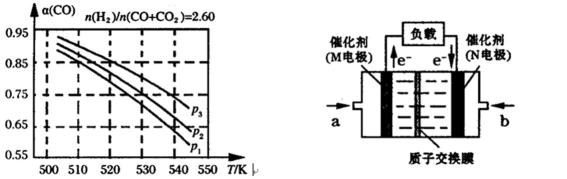
29.合成气组成n(H2)/n(CO+CO2)=2.60时,体系中的CO平衡转化率(α)与温度和压强的关系如下图所示。图中压强由大到小的顺序为_______________。
30.下图是某研究机构开发的给笔记本电脑供电的甲醇燃料电池,甲醇在催化剂作用下提供质子(H+)和电子,电池总反应为:2CH3OH+3O2=2CO2+4H2O。一个甲醇分子经过电化学氧化,可以产生__________个电子的电量,其负极的电极反应式为_______________。
正确答案
(1)-99 +41
解析
断键吸收的能量与成键释放的能量之差作为反应热,,准确把握平衡常数的定义,从图表中准确分析出升高温度促使平衡想着逆方向移动,从而升温K值将减小,根据定一议二原则,能判断p3>p2>p1。从2CH3OH+3O2=2CO2+4H2O中得出,一个甲醇分子需要1.5个氧气分子,因此得失电子数为6个,电极反应式的书写采用总反应式与正极反应式相减法得出: CH3OH + H2O - 6e-=CO2+6H+
考查方向
解题思路
把握键能与反应热计算的方法、平衡移动原理以及影响平衡的因素加以验证。电极反应式的书写可以采用做减法,但特别注意传到的是(H+)
易错点
键能计算、平衡常数与温度的关系、平衡移动因素、原电池电极反应式
正确答案
K2 = K1 K3 减小
解析
断键吸收的能量与成键释放的能量之差作为反应热,,准确把握平衡常数的定义,从图表中准确分析出升高温度促使平衡想着逆方向移动,从而升温K值将减小,根据定一议二原则,能判断p3>p2>p1。从2CH3OH+3O2=2CO2+4H2O中得出,一个甲醇分子需要1.5个氧气分子,因此得失电子数为6个,电极反应式的书写采用总反应式与正极反应式相减法得出: CH3OH + H2O - 6e-=CO2+6H+
考查方向
解题思路
把握键能与反应热计算的方法、平衡移动原理以及影响平衡的因素加以验证。电极反应式的书写可以采用做减法,但特别注意传到的是(H+)
易错点
键能计算、平衡常数与温度的关系、平衡移动因素、原电池电极反应式
正确答案
p3>p2>p1
解析
断键吸收的能量与成键释放的能量之差作为反应热,,准确把握平衡常数的定义,从图表中准确分析出升高温度促使平衡想着逆方向移动,从而升温K值将减小,根据定一议二原则,能判断p3>p2>p1。从2CH3OH+3O2=2CO2+4H2O中得出,一个甲醇分子需要1.5个氧气分子,因此得失电子数为6个,电极反应式的书写采用总反应式与正极反应式相减法得出: CH3OH + H2O - 6e-=CO2+6H+
考查方向
解题思路
把握键能与反应热计算的方法、平衡移动原理以及影响平衡的因素加以验证。电极反应式的书写可以采用做减法,但特别注意传到的是(H+)
易错点
键能计算、平衡常数与温度的关系、平衡移动因素、原电池电极反应式
正确答案
6 CH3OH + H2O - 6e-=CO2+6H+
解析
断键吸收的能量与成键释放的能量之差作为反应热,,准确把握平衡常数的定义,从图表中准确分析出升高温度促使平衡想着逆方向移动,从而升温K值将减小,根据定一议二原则,能判断p3>p2>p1。从2CH3OH+3O2=2CO2+4H2O中得出,一个甲醇分子需要1.5个氧气分子,因此得失电子数为6个,电极反应式的书写采用总反应式与正极反应式相减法得出: CH3OH + H2O - 6e-=CO2+6H+
考查方向
解题思路
把握键能与反应热计算的方法、平衡移动原理以及影响平衡的因素加以验证。电极反应式的书写可以采用做减法,但特别注意传到的是(H+)
易错点
键能计算、平衡常数与温度的关系、平衡移动因素、原电池电极反应式
高硫煤脱硫分为燃烧前、燃烧中及燃烧后脱硫。
11.燃烧前脱硫:可用生物脱硫法,即在酸性环境下,有些种类的细菌能利用空气将Fe2+氧化成Fe3+而获得能量,Fe3+再与煤中的FeS2(Fe为+2价)反应使硫转化为硫酸根离子而去除。写出生物脱硫法的离子方程式 、 。
12.燃烧中脱硫:通过加入石灰石,在燃烧过程中将硫元素以CaSO4的形式固定,从而降低SO2的排放。已知钙的燃烧热635kJ·mol-1,硫的燃烧热297kJ·mol-1、硫酸钙的生成焓△H=-1434kJ·mol-1(即由1molCa(s)、1molS(s)、2molO2(g)生成1molCaSO4(s)的△H值),则CaO(s)+SO2(g)+1/2O2(g)==CaSO4(s) ,△H= kJ·mol-1。
13.燃烧后脱硫:以Na2SO3溶液作为吸收液,利用钠碱循环法脱除烟气中的SO2。图一中横坐标为pH,纵坐标X(i)为各含硫微粒占所有含硫微粒的物质的量分数。
①已知某次吸收液中n(SO32-):n(HSO3-)=10:1,则溶液的pH= 。
②当吸收液的pH约为6时,需电解再生。原理如图二所示。
Ⅰ.Pt(I)电极反应式 。
Ⅱ.H2SO4浓度,a%与b%的大小关系为 。
14.取10.00g干煤在1350℃以上的空气中充分燃烧,其中硫元素转化为SO2和少量的 SO3(g),氯元素转化为HCl,产生的气体用适量的双氧水吸收,所得溶液稀释至 100.0mL,每次取10.00mL用0.1000mol·L-1NaOH溶液进行滴定,滴定后的溶液加入适量的羟基氰化汞〔Hg(OH)CN〕,[发生反应:NaCl+Hg(OH)CN==Hg(Cl)CN+NaOH]再用H2SO4滴定,平均消耗15.55mLNaOH溶液和1.25×10-5mol的H2SO4。该煤中硫的质量分数为 。
正确答案
① 4H++4Fe2++O2 == 4Fe3++2H2O
② 8H2O+FeS2+14Fe3+==15Fe2++16H++2SO42-
解析
生物脱硫法,即在酸性环境下,有些种类的细菌能利用空气将Fe2+氧化成Fe3+,其离子反应方程式为:4H++4Fe2++O2 == 4Fe3++2H2O ;Fe3+再与煤中的FeS2(Fe为+2价)反应使硫转化为硫酸根离子而去除,离子方程式为:8H2O+FeS2+14Fe3+==15Fe2++16H++2SO42- 故答案为:① 4H++4Fe2++O2 == 4Fe3++2H2O;② 8H2O+FeS2+14Fe3+==15Fe2++16H++2SO42-
考查方向
解题思路
生物脱硫法,即在酸性环境下,有些种类的细菌能利用空气将Fe2+氧化成Fe3+而获得能量,Fe3+再与煤中的FeS2(Fe为+2价)反应使硫转化为硫酸根离子而去除,根据反应物结合质量守恒定律、电荷守恒书写离子方程式;
易错点
电离平衡常数应用、解池阴极阳极的判断 电极反应式的书写电解液的变化、中和滴定的原理、关系式法计算。
正确答案
-502
解析
已知钙的燃烧热635kJ·mol-1,硫的燃烧热297kJ·mol-1、硫酸钙的生成焓△H=-1434kJ·mol-1(即由1molCa(s)、1molS(s)、2molO2(g)生成1molCaSO4(s)的△H值);
Ca + 1/2O2 =CaO △H=--635kJ·mol-1 ①
S + O2 = SO2 △H=-297kJ·mol-1 ②
Ca + S + 2O2 ==CaSO4 △H=-1434kJ·mol-1 ③
由③-①-②和盖斯定律可得:CaO(s)+SO2(g)+1/2O2(g)==CaSO4(s) ,△H=-502 kJ·mol-1 ,故答案为:502
考查方向
解题思路
已知钙的燃烧热635kJ·mol-1,硫的燃烧热297kJ·mol-1、硫酸钙的生成焓△H=-1434kJ·mol-1(即由1molCa(s)、1molS(s)、2molO2(g)生成1molCaSO4(s)的△H值);
Ca + 1/2O2 =CaO △H=--635kJ·mol-1 ①
S + O2 = SO2 △H=-297kJ·mol-1 ②
Ca + S + 2O2 ==CaSO4 △H=-1434kJ·mol-1 ③
由③-①-②和盖斯定律可得:CaO(s)+SO2(g)+1/2O2(g)==CaSO4(s) ,△H求出。
易错点
电离平衡常数应用、解池阴极阳极的判断 电极反应式的书写电解液的变化、中和滴定的原理、关系式法计算。
正确答案
① 8.18
②Ⅰ. 2HSO3-+2e-==SO32-+H2↑或2H++2e-==H2↑
Ⅱ. a%
解析
H2SO3


②Ⅰ。当吸收液的pH降至约为6时,Pt(I)极2H++2e-==H2,溶液中阳离子H+ ,具有氧化性,在阴极上得到电子放电发生还原反应;Ⅱ. Pt(Ⅱ)极溶液中阴离子主要为HSO3-,具有还原性,在阳极上放电发生氧化反应;HSO3--2e-+H2O=SO42-+3H+ ,c(SO42-)增大,故答案为Ⅰ. 2HSO3-+2e-==SO32-+H2↑或2H++2e-==H2↑;Ⅱ. a%
考查方向
解题思路
SO2+H2O=H2SO3,H2SO3

易错点
电离平衡常数应用、解池阴极阳极的判断 电极反应式的书写电解液的变化、中和滴定的原理、关系式法计算。
正确答案
2.448%(2.5%、2.45%均不扣分)
解析
取10.00g干煤在1350℃以上的空气中充分燃烧,其中硫元素转化为SO2和少量的SO3(g),氯元素转化为HCl,产生的气体用适量的双氧水吸收,所得溶液稀释至 100.0mL,此溶液为H2SO4和HCl混合溶液,每次取10.00mL用0.1000mol·L-1NaOH溶液进行滴定,其原理为HCl + NaOH=NaCl+H2O和H2SO4 +2NaOH=Na2SO4 +2H2O,消耗NaOH体积为15.55ml,后的溶液加入适量的羟基氰化汞〔Hg(OH)CN〕发生NaCl+Hg(OH)CN==Hg(Cl)CN+NaOH,即使NaCl转化为NaOH后,再用H2SO4溶液滴定,耗H2SO4物质的量为1.25×10-5mol,其关系式为:2HCl~2NaCl~2NaOH~H2SO4 ;可求出混合溶液n(HCl)=2.5×10-5mol,消耗NaOH的n(NaOH)=2.5×10-5mol;与混合溶液中H2SO4反应消耗的n(NaOH)= 15.55×10-3 L×0.1mol/L -2.5×10-5 =1.53×10-2 mol; 由H2SO4~2NaOH可得,10ml混合液中n(H2SO4)=7.65×10-3 mol;即100ml混合液中n(H2SO4)=7.65×10-2 mol,根据硫元素守恒,可知10.00g干煤中m(S)=n(S)×32g/mol=7.65×10-2 mol×32g/mol=0.2448g,该煤中硫的质量分数w(s)=0.2448g/10g×100%=2.448%,故答案为2.448%。
考查方向
解题思路
取10.00g干煤在1350℃以上的空气中充分燃烧,其中硫元素转化为SO2和少量的SO3(g),氯元素转化为HCl,产生的气体用适量的双氧水吸收,所得溶液稀释至 100.0mL,此溶液为H2SO4和HCl混合溶液,每次取10.00mL用0.1000mol·L-1NaOH溶液进行滴定,其原理为HCl + NaOH=NaCl+H2O和H2SO4 +2NaOH=Na2SO4 +2H2O,消耗NaOH体积为15.55ml,后的溶液加入适量的羟基氰化汞〔Hg(OH)CN〕发生NaCl+Hg(OH)CN==Hg(Cl)CN+NaOH,即使NaCl转化为NaOH后,再用H2SO4溶液滴定,耗H2SO4物质的量为1.25×10-5mol,其关系式为:2HCl~2NaCl~2NaOH~H2SO4 ;可求出混合溶液n(HCl)=2.5×10-5mol,消耗NaOH的n(NaOH)=2.5×10-5mol;与混合溶液中H2SO4反应消耗的n(NaOH)= 15.55×10-3 L×0.1mol/L -2.5×10-5 =1.53×10-2 mol; 由H2SO4~2NaOH可得,10ml混合液中n(H2SO4)=7.65×10-3 mol;即100ml混合液中n(H2SO4)=7.65×10-2 mol,根据硫元素守恒可解答此题。
易错点
电离平衡常数应用、解池阴极阳极的判断 电极反应式的书写电解液的变化、中和滴定的原理、关系式法计算。
5. 研究反应物的化学计量数与产物之间的关系时,使用类似数轴的方法可以收到直观形象的效果。下列表达不正确的是( )
正确答案
解析
A. FeI2溶液中通入氯气后铁和碘的存在形式:
B.反应的化学方程式:4HNO3(稀足)+Fe═Fe(NO3)3+NO↑+2H2O,8HNO3+3Fe═3Fe(NO3)2+2NO↑+4H2O,Fe与HNO3的物质的量之比为1:4时,恰好反应生成Fe(NO3)3,即Fe与HNO3的物质的量之比为≤ 1/4时反应得到Fe(NO3)3,Fe与HNO3的物质的量之比为3:8时,恰好反应生成Fe(NO3)2,即Fe与HNO3的物质的量之比为≥ 3/8时反应得到Fe(NO3)2;
C .Al3++3OH-=Al(OH)3↓,Al3++4OH-=AlO2-+2H2O,



D.烧碱溶液中通入少量二氧化硫反应生成亚硫酸钠,n(NaOH):n(SO2)=2:1反应生成亚硫酸钠,通入过量二氧化硫生成亚硫酸氢钠,n(NaOH):n(SO2)=1:1,反应生成亚硫酸氢钠,在2:1~1:1范围内生成亚硫酸钠和亚硫酸氢钠。
考查方向
解题思路
A、氯气与铁按照2:1反应;和碘按照2:1反应。
B、Fe和稀HNO3反应生成三价铁、三价铁和铁反应还原成二价。
C、根据可能发生的反应Al3++3OH-=Al(OH)3↓,Al3++4OH-=AlO2-+2H2O分析;
D、少量二氧化硫反应生成亚硫酸钠;过量二氧化硫反应生成亚硫酸氢钠。
易错点
离子方程式的定量产物的分析。
知识点
下列对应关系不正确的是
正确答案
解析
略
知识点
下列化合物中,在常温常压下以液态形式存在的是
正确答案
解析
本题非常简单,属于识记类考查,其中甲醇为液态为通识性的知识。
知识点
化学与生活密切相关。下列说法不正确的是
正确答案
解析
略
知识点
某有机物的结构如图所示,下列有关它的说法正确的是
正确答案
解析
略。
知识点
27.甲醇是一种很好的燃料,工业上用CH4和H2O为原料,通过反应Ⅰ和Ⅱ来制备甲醇。
⑴将1.0 mol CH4和2.0 mol H2O(g)通入反应室(容积
为100L),在一定条件下发生反应:
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
扫码查看完整答案与解析