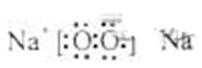- 元素周期律和元素周期表的综合应用
- 共63题
X、Y、Z、Q、R是五种短周期元素,原子序数依次增大。X、Y两元素最高正价与最低负价之和均为0:Q与X同主族:Z、R分别是地壳中含量最高的非金属元素和金属元素。
请回答下列问题:
(1)五种元素原子半径由大到小的顺序是(写元素符号) 。
(2)X与Y能形成多种化合物其中既含极性键又含非极性键,且相对分子质量最小的物质是(写分子式) 。
(3)由以上某些元素组成的化合物A、B、C、D有如下转化关系:
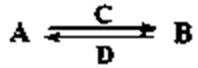
其中,C是溶于水显酸性的气体;D是淡黄色固体。
写出C的结构式: ;D的电子式: 。
①如果A、B均由三种元素组成,B为两性不溶物,则A的化学式为 ;由A转化为B的离子方程式为 。
②如果A由三种元素组成,B由四种元素组成,A、B溶液均显碱性。用离子方程式表示A溶液显碱性的原因: 。A、B浓度均为0.1mol·L-1的混合溶液中,离子浓度由大到小的顺序是 ;常温下,在该溶液中滴加稀盐酸至中性时,溶质的主要成分有 。
正确答案
见解析
解析
解析:该题以周期律和周期表为基础知识,考查元素推断、重要元素化合物的性质、化学用语、电解质溶液中离子浓度大小比较等重要知识。
(1) 根据短周期元素、X、Y元素的X、Y两元素最高正价与最低负价之和均为0;推知X Y元素分别为H和C,Q与X同主族推知Q为Na元素,Z、R分别是地壳中含量最高的非金属元素和金属元素,推知Z为O元素,R为Al元素。
原子半径大小顺序为Na>Al>C>O>H
(2)C和H形成的物质是有机化合物,含极性键又含非极性键,分子质量最小的只能是
C2H2
(3)C溶于水显酸性的气体只能是CO2,D是淡黄色固体,只能是过氧化钠
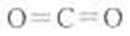
①B为两性不溶物,AB均由三种元素组成,根据转化关系A为NaAlO2,
B为Al(OH)3由A转化为B的离子方程式AlO2-+2H2O+CO2=Al(OH)3+HCO3-或
2AlO2-+3 H2O+CO2=2 Al(OH)3+CO32-
②A由三种元素组成,B由四种元素组成,A、B溶液均显碱性,A是Na2CO3,B是NaHCO3.A显碱性的原因是CO32-的水解。水解的离子方程式为CO32-+H2O
知识点
X、Y、Z、W是元素周期表中原子序数依次增大的四种短周期元素,其相关信息如下表:
(1)W位于元素周期表第 周期第 族;W的原子半径比X的 (填“大”或“小”)。
(2)Z的第一电离能比W的 (填“大”或“小”); 


(3)震荡下,向Z单质与盐酸反应后的无色溶液中滴加

(4)在25°、101



正确答案
(1)三 NA 小
(2)小 分子间作用力(范德华力) 甲醛(甲酸)
(3)先产生白色沉淀,后沉淀溶解 Si + 4HF = SiF4
(4)2Al + 3 O2 =Al2O3 △H= -1675KJmol
解析
X的最高价氧化对应的水化物为H2XO3,可以确定X为+4价,故可能为C、Si;Y是地壳中含量最高的为O,Z、最外层电子为3s23p1,为Al;W质子数为28-14=14为Si,故综上有X、Y、Z、W分别为C、O、Al、Si。
知识点
图7是部分周期元素化合价与原子序数的关系图,下列说法正确的是
正确答案
解析
从图看知:X为O,Y为Na,Z为Al,W为S,R为Cl。A.应该是Y>Z>X。C.硫酸为共价化合物。
知识点
四种短周期元素在周期表中的位置如下图,其中只有M为金属元素。下列说法不正确的是
正确答案
解析
略
知识点
甲、乙、丙、丁、戊为原子序数依次增大的短周期元素。甲、丙处于同一主族,丙、丁、戊处于同一周期,戊原子的最外层电子数是甲、乙、丙原子最外层电子数之和。甲、乙组成的成见气体X能使湿润的红色石蕊试纸变蓝;戊的单质与X反应能生成乙的单质,同时生成两种溶于水均呈酸性的化合物Y和Z,0.1 mol/L的Y溶液pH>1;丁的单质既能与丙元素最高价氧化物的水化物的溶液反应生成盐L也能与Z的水溶液反应生成盐;丙、戊可组成化合物M。
请回答下列问题:
(1)戊离子的结构示意图为_______。
(2)写出乙的单质的电子式:_______。
(3)戊的单质与X反应生成的Y和Z的物质的量之比为2:4,反应中被氧化的物质与被还原的物质的物质的量之比为________。
(4)写出少量Z的稀溶液滴入过量L的稀溶液中发生反应的离子方程式:_________。
(5)按右图电解M的饱和溶液,写出该电解池中发生反应的总反应方程式:_______。将充分电解后所得溶液逐滴加入到酚酞试液中,观察到得现象是__________。
正确答案
(1) 
(2)
(3)2:3
(4)AlO2- +H++H2O=Al(OH)3↓
(5)2NaCl+2H2O
解析
甲、乙组成的常见气体X能使湿润的红色石蕊试纸变蓝,则X是NH3,甲是H,乙是N。甲、丙处于同一主族,并且丙的原子序数大于N,则丙是Na。根据戊原子的最外层电子数是甲、乙、丙原子的最外层电子数之和,则戊原子最外层电子数=1+1+5=7,则戊是Cl。戊的单质是Cl2,与NH3反应生成乙的单质N2和NH4Cl、HCl;并且0.1 mol·L-1的Y溶液的pH>1,则Y是NH4Cl,Z是HCl。
丁的单质能与NaOH溶液反应,也能与HCl水溶液反应,则丁是Na,生成的盐L是NaAlO2。丙、戊组成的化合物M为NaCl。
知识点
短周期元素X、Y、Z、W、Q在元素周期表的位置如表所示,其中X元素的原子内层电子数是最外层电子数的一半,则下列说法正确的是
正确答案
解析
由“X元素的原子内层电子数是最外层电子数的一半”可推出X为C,因此Y为O,Z为Si,W为S,Q为Cl。A选项:Na和S可形成类似于Na2O 2 的Na2S2。Z与Y组成的物质是SiO2,SiO2是原子晶体,熔融时不能导电。C选项:S得电子能力比Cl弱。D选项:C、O元素都能形成多种同素异形体。
知识点
如表所示的五种元素中,W、X、Y、Z为短周期元素,这四种元素的原子最外层电子数之和为22。下列说法正确的是
正确答案
解析
略
知识点
短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图1所示。下列说法正确的是
正确答案
解析
该题以“周期表中元素的推断”为载体,考查学生对元素周期表的熟悉程度及其对表中各元素性质和相应原子结构的周期性递变规律的认识和掌握程度。考查了学生对物质结构与性质关系以及运用元素周期律解决具体化学问题的能力。
推出的元素为:X:N ; Y :O ; Z: Al ; W :S ; Q :Cl
A.元素最高正化合价一般等于其主族数。
B.同周期原子半径从左到右依次减小,同主族从上到下依次增大。
C.离子Y2-和Z 3+都为10微粒,核外电子数和电子层数都相同。
D. 元素最高价氧化物对应的水化物的酸性是与非金属性一致的,因此酸性Q的强。
知识点
某短周期非金属元素的原子核外最外层电子数是次外层电子数的一半,该元素
正确答案
解析
短周期中最外层电子数是次外层电子数一半的有Li:

知识点
A、B、D、E、F为短周期元素,非金属元素A最外层电子数与其周期数相同,B的最外层电子数是其所在周期数的2倍。B 在D中充分燃烧能生成其最高价化合物


(1)A在周期表中的位置是_______,写出一种工业制备单质F的离子方程式_______。(每空2分)
(2)B、D、E组成的一种盐中,E的质量分数为43%,其俗名为_______(1分),其水溶液与F单质反应的化学方程式为_______(2分),在产物中加入少量KI,反应后加人
(3)由这些元素组成的物质,其组成和结构信息如下表:
a的化学式为_______(1分);b的化学式为_______(2分);c的电子式为_______(1分);d的晶体类型是_______(1分)。
(4)由A和B、D元素组成的两种二元化合物形成一类新能源物质。一种化合物分子通过_______(1分)键构成具有空腔的固体;另一种化合物(沼气的主要成分)分子进入该空腔,其分子的空间结构为_______(1分)。
正确答案
(1)

(2)纯碱(或苏打)
(3)



(4)氢;正四面体
解析
略。
知识点
扫码查看完整答案与解析